Một số tiêu chuẩn FDA 21 CFR Part 11
25/12/2021
Tiêu chuẩn FDA 21 CFR Part 11- là tiêu chuẩn tuân thủ Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ về mối quan tâm sức khỏe con người. Khi tính năng này được bật tất cả thao táo trên thiết bị đều lưu lại, cho phép truy xuất thông tin theo đúng với thông tin đăng nhập được cho phép. Dữ liệu được bảo vệ bằng chính tài khoản của đăng nhập và được đối chiếu chính thông trên thiết bị PR

Tất cả các sự kiện hệ thống bao gồm thay đổi cấu hình, mất điện đều được ghi lại. Tất cả các mục nhập đều được đóng dấu thời gian và ngày tháng, bao gồm cả id nhà điều hành. Nhật ký đánh giá chi tiết đi kèm với tất cả dữ liệu quy trình được ghi lại bởi thiết bị PR10 / PR20 / PR30
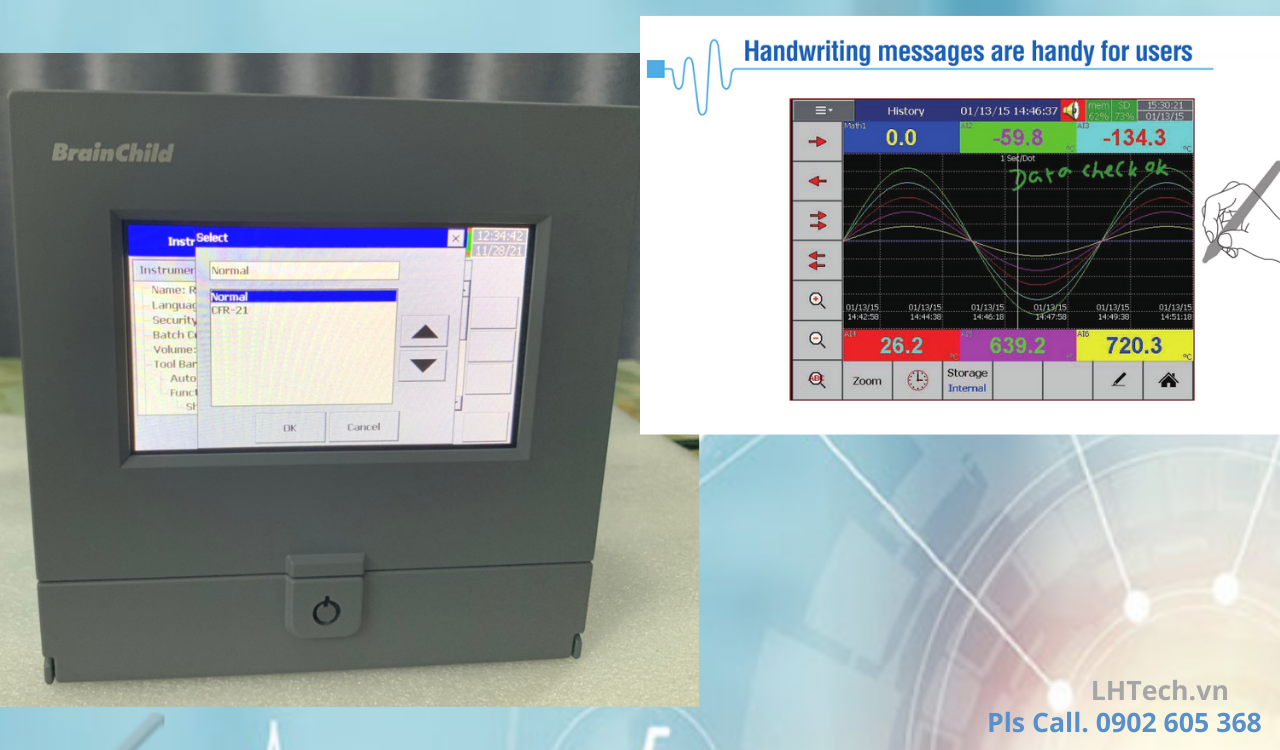
PR 10-PR20-PR30 -bộ ghi theo chuẩn-FDA 21 CFR Part 11
Tham khảo một số tiêu chí trong tiêu chuẩn FDA 21 CFR part 11 compliance..
On August 20th 1997 the Food and Drug Administration made 21 CFR Part 11 came into effective. This regulation is summarized as follows:
“The Food and Drug Administration (FDA) is issuing regulations that provide criteria for acceptance by FDA, under certain circumstances, of electronic records, electronic signatures, and handwritten signatures executed to electronic records as equivalent to paper records and handwritten signatures executed on paper. These regulations, which apply to all FDA program areas, are intended to permit the widest possible use of electronic technology, compatible with FDA’s responsibility to promote and protect public health. The use of electronic records as well as their submission to FDA is voluntary.”
Tạm dịch:
Vào ngày 20 tháng 8 năm 1997, Cơ quan Quản lý Thực phẩm và Dược phẩm đã ban hành 21 CFR Phần 11 có hiệu lực. Quy định FDA 21 CFR phần 11 tuân thủ.
Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) đang ban hành các quy định cung cấp các tiêu chí để FDA chấp nhận, trong một số trường hợp nhất định, hồ sơ điện tử, chữ ký điện tử và chữ ký viết tay được thực hiện thành hồ sơ điện tử tương đương với hồ sơ giấy và chữ ký viết tay được thực hiện trên giấy. Các quy định này, áp dụng cho tất cả các lĩnh vực chương trình của FDA, nhằm cho phép sử dụng công nghệ điện tử rộng rãi nhất có thể, tương thích với trách nhiệm của FDA trong việc thúc đẩy và bảo vệ sức khỏe cộng đồng. Việc sử dụng các hồ sơ điện tử cũng như việc nộp chúng cho FDA là tự nguyện .
FDA 21 CFR Part 11 Subpart B, Section 11.10: Controls for modification
"Persons who use closed systems to create, modify, maintain, or transmit electronic records shall employ procedures and controls designed to ensure the authenticity, integrity, and when appropriate the confidentiality of electronic records, and can ensure that the signer cannot repudiate the signed record as not genuine.”
Tạm dịch: FDA 21 CFR Phần 11 Mục B, đoạn 11.10: Kiểm soát sửa đổi
Những người sử dụng hệ thống khép kín để tạo, sửa đổi, duy trì hoặc truyền hồ sơ điện tử phải sử dụng các thủ tục và kiểm soát được thiết kế để đảm bảo tính xác thực, tính toàn vẹn và tính bảo mật của hồ sơ điện tử khi thích hợp và có thể đảm bảo rằng người ký không thể từ chối hồ sơ đã ký như không chính hãng.
FDA CFR21 Part 11 Section 11.10 (b)
“The ability to generate accurate and complete copies of records in both human readable and electronic form suitable for inspection, review, and copying by the agency (FDA)"
Tạm dịch:
Khả năng tạo ra các bản sao chính xác và đầy đủ của hồ sơ ở cả dạng con người có thể đọc được và dạng điện tử phù hợp để cơ quan (FDA) kiểm tra, xem xét và sao chép
FDA CFR21 Part 11 Section11.10 (c)
“Protection of records to enable their accurate and ready retrieval throughout the records retention period”
Tạm dịch :Bảo vệ hồ sơ để cho phép truy xuất chính xác và sẵn sàng trong suốt thời gian lưu giữ hồ sơ
Tạm dịch :Bảo vệ hồ sơ để cho phép truy xuất chính xác và sẵn sàng trong suốt thời gian lưu giữ hồ sơ
FDA CFR21 Part 11 Section11.10 (d)
“Limiting system access to authorized individuals.”
Tạm dịch: Giới hạn quyền truy cập hệ thống đối với các cá nhân được ủy quyền
Tạm dịch: Giới hạn quyền truy cập hệ thống đối với các cá nhân được ủy quyền
FDA CFR21 Part 11 Section11.10 (e)
“Use of secure, computer-generated, time-stamped audit trails to independently record the date and time of operator actions that create, modify or delete electronic records”, Record changes shall not obscure previously recorded information. Such audit trail documentation shall be retained at least as long as that required for the subject electronic records and shall be available for agency review and copying”
Tạm dịch:
Sử dụng các dấu vết kiểm tra an toàn, được tạo ra bằng máy tính, được đóng dấu thời gian để ghi lại ngày và giờ một cách độc lập các hành động của người vận hành nhằm tạo, sửa đổi hoặc xóa các bản ghi điện tử”, các thay đổi của bản ghi sẽ không che khuất thông tin đã ghi trước đó. Các tài liệu về lộ trình đánh giá như vậy sẽ được lưu giữ ít nhất miễn là cần thiết cho hồ sơ điện tử của đối tượng và sẽ có sẵn để cơ quan xem xét và sao chép
FDA CFR21 Part 11 Section 11.10 (g)
“Use of authority checks to ensure that only authorized individuals can use the system, electronically sign a record, access the operation or computer system input or output device, alter a record, or perform the operation at hand”
Tạm dịch:
Sử dụng kiểm tra quyền hạn để đảm bảo rằng chỉ những cá nhân được ủy quyền mới có thể sử dụng hệ thống, ký điện tử vào hồ sơ, truy cập hoạt động hoặc thiết bị đầu vào hoặc đầu ra của hệ thống máy tính, thay đổi hồ sơ hoặc thực hiện thao tác ngay lập tức
FDA CFR21 Part 11 Section 11.10 (h)
“Use of device (e.g., terminal) checks to determine, as appropriate, the validity of the source of data input or operational instruction".
Tạm dịch: Việc sử dụng thiết bị (ví dụ: thiết bị đầu cuối) kiểm tra để xác định tính hợp lệ của nguồn đầu vào dữ liệu hoặc hướng dẫn vận hành.
Tạm dịch: Việc sử dụng thiết bị (ví dụ: thiết bị đầu cuối) kiểm tra để xác định tính hợp lệ của nguồn đầu vào dữ liệu hoặc hướng dẫn vận hành.
FDA CFR21 Part 11 Section 11.10 (i)
“Determination that the persons who develop, maintain, or use electronic record/electronic signature systems have the education, training and experience to perform their assigned tasks.”
Tạm dịch : Xác định rằng những người phát triển, duy trì hoặc sử dụng hệ thống hồ sơ điện tử / chữ ký điện tử có trình độ học vấn, đào tạo và kinh nghiệm để thực hiện các nhiệm vụ được giao.
FDA CFR21 Part 11 Section 11.10 (k)
“Use of appropriate controls over systems documentation including:
(1) Adequate controls over the distribution of, access to, and use of documentation for system operation and maintenance.
(2) Revision and change control procedures to maintain an audit trail that documents time- sequenced development and modification of systems documentation.”
Tạm dịch:
Tạm dịch:
Sử dụng các biện pháp kiểm soát thích hợp đối với tài liệu hệ thống bao gồm:
(1) Các biện pháp kiểm soát đầy đủ đối với việc phân phối, truy cập và sử dụng tài liệu để vận hành và bảo trì hệ thống.
(2) Sửa đổi và thay đổi các thủ tục kiểm soát để duy trì lộ trình đánh giá ghi lại sự phát triển và sửa đổi theo trình tự thời gian đối với tài liệu hệ thống.
FDA CFR21 Part 11 Sub Part C Section 11.300: Controls for identification codes/passwords
"Persons who use electronic signatures based upon use of identification codes in combination with passwords shall employ controls to ensure their security and integrity. Such controls shall include:
(a) Maintaining the uniqueness of each combined identification code and password, such that no two individuals have the same combination of identification code and password.
(b) Ensuring that identification code and password issuances are periodically checked, recalled, or revised (e.g., to cover such events as password aging).
(c) Following loss management procedures to electronically deauthorize lost, stolen, missing, or
otherwise potentially compromised tokens, cards, and other devices that bear or generate identification code or password information, and to issue temporary or permanent replacements using suitable, rigorous controls.
(d) Use of transaction safeguards to prevent unauthorized use of passwords and/or identification codes, and to detect and report in an immediate and urgent manner any attempts at their unauthorized use to the system security unit, and, as appropriate, to organizational management.
Tạm dịch:
FDA CFR21 Phần 11 Phụ Phần C Phần 11.300: Kiểm soát mã nhận dạng / mật khẩu
Những người sử dụng chữ ký điện tử dựa trên việc sử dụng mã nhận dạng kết hợp với mật khẩu sẽ sử dụng các biện pháp kiểm soát để đảm bảo tính bảo mật và tính toàn vẹn của họ. Các biện pháp kiểm soát đó bao gồm:
(a) Duy trì tính duy nhất của từng mã nhận dạng và mật khẩu kết hợp, sao cho không có hai cá nhân nào có cùng mã nhận dạng và mật khẩu.
(b) Đảm bảo rằng các lần cấp mã nhận dạng và mật khẩu được kiểm tra, thu hồi hoặc sửa đổi định kỳ (ví dụ: để che các sự kiện như lão hóa mật khẩu).
(c) Tuân theo các quy trình quản lý tổn thất để hủy cấp phép điện tử bị mất, bị đánh cắp, mất tích hoặc
nếu không thì mã thông báo, thẻ và các thiết bị khác có khả năng bị xâm phạm hoặc tạo ra mã nhận dạng hoặc thông tin mật khẩu và để phát hành các thay thế tạm thời hoặc vĩnh viễn bằng cách sử dụng các biện pháp kiểm soát nghiêm ngặt, phù hợp.
(d) Sử dụng các biện pháp bảo vệ giao dịch để ngăn chặn việc sử dụng trái phép mật khẩu và / hoặc mã nhận dạng, đồng thời phát hiện và báo cáo một cách tức thời và khẩn cấp bất kỳ nỗ lực sử dụng trái phép nào đối với đơn vị bảo mật hệ thống và, nếu thích hợp, cho ban quản lý tổ chức .
FDA CFR21 Phần 11 là tiêu chuẩn Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) đang ban hành và có hiệu lực 20/08/1997 là tiêu chuẩn để quản lý dữ liệu được các doanh nghiệp dược phẩm, thực phẩm ứng dụng và áp dụng.
Thiết bị ghi dữ liệu nhiệt, độ ẩm, dòng, áp model PR10, PR20, PR30 của hãng BrainChild đáp ứng được yêu cầu tiêu chuẩn FDA CFR21 Part11 của cơ quan Quản lý thực phẩm và dược phẩm.
Hãy liên hệ ngay đến chúng tôi để được hỗ trợ tư vấn nhanh và miễn phí.


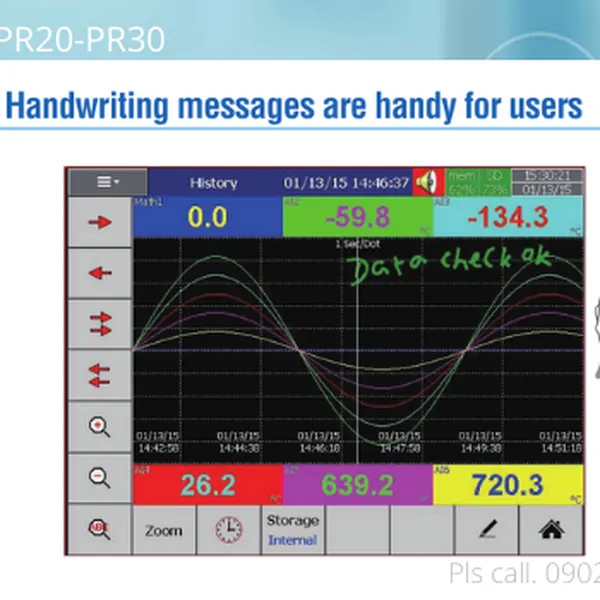






Xem thêm